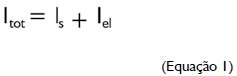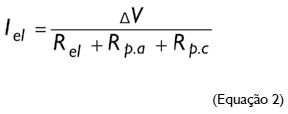Artigos
Parafusos estruturais de aço patinável na construção em aço - Parte I
Após mais de 60 artigos técnicos publicados no Brasil e no exterior, o autor apresenta nesta edição a 1ª parte do artigo sobre os aços patináveis
Introdução
 A construção em aço cria, por vezes, situações em que diferentes ligas metálicas, unidas (p.ex., por parafusos ou solda), estão presentes em um mesmo sistema. Um bom exemplo é observado nas ligações, onde parafusos estruturais (“pretos”, galvanizados a fogo, ou, ainda, em aço patinável) são empregados nas uniões de componentes estruturais em aço carbono ou em aço patinável. A construção em aço cria, por vezes, situações em que diferentes ligas metálicas, unidas (p.ex., por parafusos ou solda), estão presentes em um mesmo sistema. Um bom exemplo é observado nas ligações, onde parafusos estruturais (“pretos”, galvanizados a fogo, ou, ainda, em aço patinável) são empregados nas uniões de componentes estruturais em aço carbono ou em aço patinável.
Esta mistura de materiais ocorre, principalmente, por duas diferentes razões: <1>-Experiência prévia de uso, e, <2>-Indisponibilidade local dos itens julgados, a priori, como sendo adequados.
Em certas circunstâncias, que serão detalhadas a seguir, a união de diferentes ligas metálicas pode levar à corrosão acelerada de um dos componentes. Este fenômeno é conhecido como corrosão galvânica; as diferentes ligas metálicas formam, então, o que se chama de par galvânico. Como resultado da formação de um par galvânico, temos o aumento da velocidade de corrosão do elemento menos nobre do par. Em contrapartida, a liga mais nobre (do par) tem sua velocidade de corrosão diminuída. Este tipo de corrosão pode promover danos “cosméticos” à aparência da liga menos nobre ou, em casos extremos, uma perda de massa considerável, levando à redução drástica da vida útil do componente.
Os aços patináveis são sabidamente “mais nobres” do que os aços estruturais ao carbono. Isto é devido à sua composição química diferenciada. Eles podem, a princípio, desenvolver corrosão galvânica quando conectados aos aços estruturais comuns – fato extensivamente divulgado na literatura. Seria isto verdadeiro para todas as condições de uso? Não. Isto não é verdadeiro, para boa parte das situações vivenciadas pelo engenheiro projetista.
O risco da corrosão galvânica depende de uma série de fatores. Além do aço utilizado, as características do ambiente e o detalhe de projeto são cruciais. É difícil, senão impossível, fazer um julgamento a priori a respeito da compatibilidade
O presente artigo descreve os princípios da corrosão galvânica e os principais parâmetros que permitem aos projetistas estimar o risco da corrosão quando utilizam materiais diversos na construção de uma estrutura em aço – especialmente no caso da escolha dos parafusos estruturais.
Os Princípios da Corrosão Galvânica
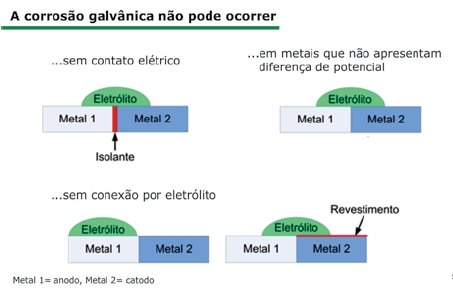
Para que a corrosão galvânica ocorra, três condições devem ser satisfeitas simultaneamente:
• Duas ou mais ligas metálicas que apresentem diferentes potenciais de corrosão (ou, potenciais eletroquímicos) devem ser conectadas;
• A conexão deve ser tal que permita o fluxo de elétrons entre as ligas;
• As ligas metálicas, conectadas “eletricamente”, devem ser banhadas por uma mesma solução condutora de íons – o eletrólito.
A Figura 1 ilustra os três pré-requisitos de forma gráfica.
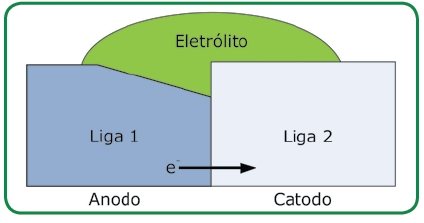
Figura 1: Os três pré-requisitos da corrosão galvânica: ligas metálicas com diferentes potenciais de corrosão, conectadas eletricamente e banhadas pelo mesmo eletrólito.
Se a corrosão galvânica puder se desenvolver, a liga menos nobre – o anodo – é preferencialmente corroída. Em oposição, a liga mais nobre – o catodo – é protegida. Sua taxa de corrosão diminui muito. De fato, o princípio da proteção catódica é baseado em anodos de sacrifício, promovendo a proteção a partir da corrosão.
O contato das duas ligas metálicas, com diferentes potenciais eletroquímicos, imersos em um eletrólito, leva ao desenvolvimento de um fluxo de elétrons do anodo para o catodo. As reações eletroquímicas são as mesmas que ocorrem enquanto as ligas metálicas estão isoladas, expostas ao ambiente particular – reações anódicas e catódicas. Entretanto, a corrosão sobre o anodo é acelerada. Em alguns casos, a formação de elementos galvânicos (conhecidos como “pares galvânicos” ou “pilhas galvânicas”) pode levar à corrosão em ligas que seriam resistentes à corrosão em dado ambiente. Este pode ser o caso de ligas consideradas passivas em ambientes atmosféricos, como alumínio, que pode ser levado à corrosão pela formação de pares galvânicos. Em tais casos, a corrosão localizada (como a corrosão por frestas ou pites) pode ser observada, o que não ocorreria sem que houvesse alteração de potencial, causada pela formação de um par galvânico.
Contrariamente ao que se acredita, a diferença de potencial existente no par galvânico, por si só, não é um bom indicador do risco da ocorrência deste tipo de corrosão. Ela somente indica quando este risco deve ser considerado. Neste contexto, deve ser lembrado que as várias tabelas publicadas - chamadas de “Série Eletroquímica”, somente oferecem uma aproximação à questão da diferença de potenciais. O fator decisivo não é a diferença de potencial observada em condições experimentais normatizadas, rigidamente controladas, mas a diferença real de potencial, de ligas reais, sob condições reais. Esta é a razão pela qual as tabelas empíricas de “Série Galvânica” foram feitas para certo número de ambientes típicos – como, p.ex., a água do mar. A Figura 2 ilustra a série galvânica, para água do mar, a 25°C.
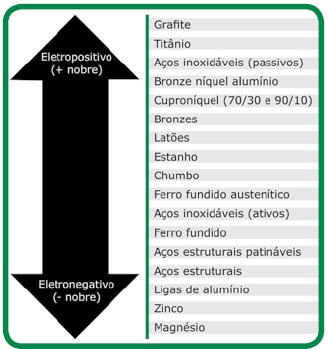
Figura 2: Série galvânica para diferentes ligas imersas em água do mar, a 25°C.
O conhecimento dos fatores necessários ao desenvolvimento da corrosão galvânica e entendimento dos exemplos relacionados na figura 3 torna possível a determinação de ações preventivas, que serão discutidas a seguir.
Fatores relevantes ao desenvolvimento da corrosão galvânica
De acordo com a Lei de Faraday, os processos de corrosão eletroquímica estão diretamente relacionados à transferência de cargas elétricas, isto é, ao fluxo de correntes. Correntes ou densidades de corrente são, assim, frequentemente utilizadas para medir a velocidade de corrosão. Se as condições para a ocorrência da corrosão galvânica forem satisfeitas, em princípio, a corrente de corrosão total, Itot, é composta de uma corrente parcial de “auto-corrosão” Is (isto é, a parte da corrosão que independe do contato com a outra liga metálica) e a corrente parcial da cela, Iel, (isto é, a parte da corrosão originada pela união das ligas metálicas que compõe o par galvânico). Isto é descrito pela Equação 1:
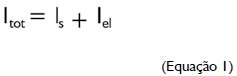
A intensidade da corrosão em dado elemento é determinada pela diferença de potencial entre os dois metais (ΔV), a resistência do eletrólito (Rel) e a resistência de polarização no anodo (Rp,a) e no catodo (Rp,c), respectivamente (Equação 2):
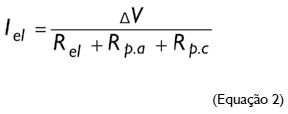
Podemos fazer inferências, utilizando a equação 2, a respeito dos fatores que determinam a corrosão galvânica. Estes fatores são críticos na avaliação da possível ocorrência ou não da corrosão galvânica. O efeito destes fatores será discutido individualmente, a seguir.
Resistividade do eletrólito
O risco da corrosão galvânica diminui com o aumento da resistividade do eletrólito. Isto acontece porque o alcance da corrente galvânica (iônica, no eletrólito) é reduzido e a mudança de potencial (V) no anodo é limitada, tal como ilustrado na figura 4.
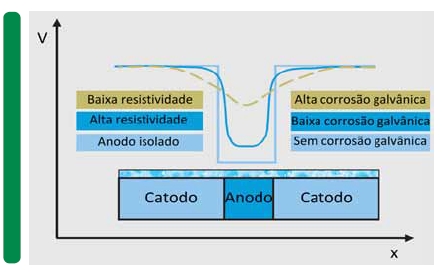
Figura 4: Influência da resistividade do eletrólito sobre a corrosão (ou, despolarização) do anodo (V corresponde ao potencial medido).
É importante lembrar que a resistividade é inversamente proporcional à quantidade de sais dissolvidos em solução. Ambientes mais poluídos levam a eletrólitos de menor resistividade, e vice-versa.
Para eletrólitos com maior resistividade (como películas de água resultantes de condensação de vapor de água, como o orvalho), haverá, consequentemente, uma menor velocidade de corrosão. Assim, quanto mais sais dissolvidos no eletrólito, maior será a corrosão do anodo, causada pelo efeito galvânico.
Ambientes atmosféricos classificados como de muita alta agressividade, industriais ou marinhos (C5-I e C5-M, segundo a norma ISO 9223) são aqueles em que, devido à menor resistividade do eletrólito superficial, a corrosão galvânica se desenvolve com certa frequência. A Tabela 1 traz valores específicos de condutividade (o inverso da resistividade), para vários tipos de eletrólitos aquosos.
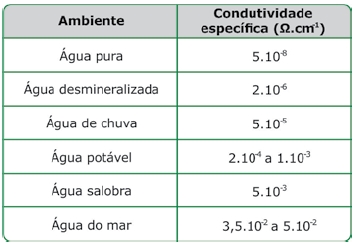
Tabela 1: Valores típicos de condutividade específica em diferentes tipos de água.
Duração do umedecimento
Existe uma forte interação entre a resistividade do eletrólito e a duração do umedecimento. Menor resistividade implica em maior quantidade de sais em solução no eletrólito que, por sua vez, resiste mais ou menos à desidratação completa. Não é possível secar completamente uma superfície metálica previamente exposta, p.ex., a deposição de sais marinhos (a névoa salina). Isto é de grande importância sempre que os componentes do par galvânico não estiverem permanentemente umedecidos por líquidos aquosos. Como descrito anteriormente, a película de eletrólito desempenha papel fundamental no processo. Sem a película, a corrosão galvânica não ocorrerá.
Isto implica, na prática, que qualquer combinação de materiais metálicos a princípio não é problema desde que não exista película de eletrólito presente. Esta é uma situação típica para interiores sem condensação. Componentes de iluminação (p.ex., lustres), em ambientes interiores, costumam unir diferentes ligas metálicas (latão, alumínio, etc.). A corrosão galvânica raramente é observada nestas condições. De modo geral, ambientes secos, aerados (e, eventualmente, aquecidos) não impõe restrição à união de diferentes ligas metálicas. A figura 5 ilustra um caso de união de aço inoxidável com aço carbono pintado em um ambiente interior. Não haverá o desenvolvimento de corrosão galvânica.
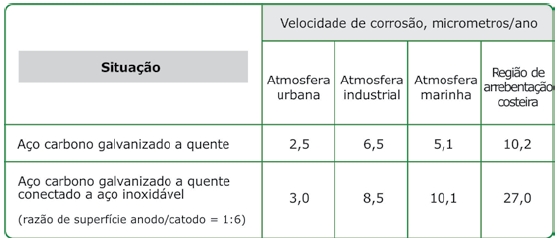
O tempo de exposição à determinada umidade e a resistividade do eletrólito são muito dependentes das condições locais. Em ambientes marinhos, industriais ou internos como as piscinas cobertas, p.ex, a probabilidade da ocor- rência da corrosão galvânica é significativamente maior que em condições mais brandas, como aquelas observadas nos ambientes rurais ou mesmo cidades médias a grandes (agressividade atmosférica classificada como C2 E C3 segundo a ISO 9223). A tabela 2 mostra a influência do ambiênte sobre a velocidade de corrosão do zinco, com e sem contato com o aço inoxidável - um par galvânico normalmente considerado "perigoso". Podemos observar que a parcela da corrosão proporcionada pela formação do par galvânico (isto é, a diferença entre as velocidades de corrosão entre componentes isolados e unidos) excede a da auto corrosão (isto é, a velocidade de corrosão do zinco sem qualquer contato com o aço inoxidável) em atmosferas marinhas e regiões sujeitas à forte deposição de sais marinhos.

Figura 5: Eletrólitos são, de modo geral, ausentes em ambientes internos aerados e aquecidos. A Combinação de ligas metálicas tais como aços inoxidáveis e aços carbono (pintado ou não) não envolvem riscos do aparecimento da corrosão galvânica.
Além do ambiente em si, detalhes de projeto desempenham um papel decisivo na proteção. Fatores que auxiliam a secagem rápida de películas de unidade (aeração adequada, prevenção de frestas, drenagem das águas, etc.) reduzem o risco da corrosão. Áreas permanentemente úmidas, contidas em frestas, áreas protegidas (mas contendo água estagnada) ou superfícies contendo resíduos, tais como terra, podem acelerar consideravelmente a corrosão galvânica.
A cinética das reações de eletrodo
A cinética das reações de eletrodo (entenda-se velocidade de corrosão) é sintetizada na Equação 3. Diferenças de potencial por vezes consideradas pequenas, como 100 mV, podem levar à corrosão, enquanto que ligas metálicas com diferenças de potencial consideravelmente mais elevadas (p.ex., 800 mV) podem ser unidas sem dificuldade. Porque isto acontece?
De fato, a diferença de potencial não fornece informação sobre a cinética da corrosão galvânica. A cinética da reação depende da liga metálica em particular. O titânio, por exemplo, permite que a reação de redução de oxigênio sobre sua superfície ocorra de modo muito mais lento do que sobre o cobre. Isto explica porque o aço carbono corrói mais rapidamente em contato com o cobre do que com o titânio, embora este último esteja situado no “limite” da série galvânica. Neste contexto, a formação de películas de corrosão desempenha um papel decisivo. Elas podem alterar significativamente o potencial de uma liga metálica e ser obstáculo à reação parcial anódica e/ou catódica.
Fabio Domingos Pannoni
Bacharel em Química pelo Instituto de Química da USP, Mestre e Doutor em Engenharia Metalúrgica pela Escola Politécnica da Universidade de São Paulo. Consultor Técnico da Gerdau Aços Brasil e do CBCA – Centro Brasileiro da Construção em Aço. Professor do Programa de Educação Continuada em Engenharia (PECE) da Escola Politécnica da USP. Possui duas patentes de aços e mais de sessenta artigos técnicos publicados no Brasil e no exterior. Autor e co-autor de quatro livros publicados. Recebeu oito prêmios de reconhecimento, dentre os quais se destacam o “Prêmio Jovem Cientista” (CNPq, Grupo Gerdau e Fundação Roberto Marinho), “Prêmio Governador do Estado” (Governo do Estado de São Paulo) e “Prêmio Talento Brasileiro” (FIESP). fabio.pannoni@gerdau.com.br
A parte final deste artigo será publicada em nossa próxima edição.
|
 Edições on-line
Edições on-line  Fale Conosco
Fale Conosco 


 CONTEÚDO DA EDIÇÃO
CONTEÚDO DA EDIÇÃO




 Edição 102
Edição 102 A construção em aço cria, por vezes, situações em que diferentes ligas metálicas, unidas (p.ex., por parafusos ou solda), estão presentes em um mesmo sistema. Um bom exemplo é observado nas ligações, onde parafusos estruturais (“pretos”, galvanizados a fogo, ou, ainda, em aço patinável) são empregados nas uniões de componentes estruturais em aço carbono ou em aço patinável.
A construção em aço cria, por vezes, situações em que diferentes ligas metálicas, unidas (p.ex., por parafusos ou solda), estão presentes em um mesmo sistema. Um bom exemplo é observado nas ligações, onde parafusos estruturais (“pretos”, galvanizados a fogo, ou, ainda, em aço patinável) são empregados nas uniões de componentes estruturais em aço carbono ou em aço patinável.